
MP Board Class 12 Chemistry imp Question 2022 | कक्षा 12 रसायन विज्ञान महत्वपूर्ण प्रश्न 2022 ( अध्याय – 7 – P ब्लॉक के तत्व )
पाठ 7 ब्लॉक के तत्व
1. निम्नलिखित में सर्वाधिक स्थायी है –
(अ) AsH3 (ब) SbH3 (स) pH3 (द) NH3
2. निम्न में से किस अणु के केंद्रीय परमाणु पर एकाकी इलेक्ट्रॉन युग्म होता है –
(अ) Cl2 (ब) CH3 (स) CHCl3 (द) NH3
3. SO2 अणु में सल्फर परमाणु का संकरण है-
(अ) Sp (ब) Sp2 (स) Sp2 (द) Sp3d
4. फलुओरीन की ऑक्सीकरण संख्या है-
(अ) +1 (ब) -1 (स) -2 (द) +2
5. सर्वाधिक इलेक्ट्रॉन लब्धि एन्थैल्पी वाला तत्व है-
(अ) N (ब) O (स) Cl (द) F
6. प्रश्न हीलियम का प्रमुख स्त्रोत है-
(अ) हवा (ब) मोनाजाइट सेण्ड (स) रेडियम (द) इनमें से कोई नहीं
अति लघु उत्तरीय प्रश्न ( MP Board Class 12 Chemistry imp Question 2022 pdf )
7. फास्फोरस PF5बनाता है जबकि नाइट्रोजन NF5 नहीं बनाता है कारण सहित स्पष्ट कीजिए।
उत्तर – PF5 का बनना सम्भव है क्योंकि P के तीसरे कोश में d – कक्षक सम्भव है। जिसके कारक उत्तेजित अवस्था में P निम्न विन्यास सम्भव है-
P = 1s2, 2s2, 2p6, 3s1, 3px1, 3py1, 3p1/2
जबकि NF5 में नाइट्रोजन के दूसरे बाह्यकोश में d-कक्षक सम्भव नहीं है।
प्रश्न 8. सल्फ्यूरिक अम्ल का प्रयोग NH3 गैस के शुष्कन में क्यों नहीं किया जाता है?
उत्तर – क्योंकि सल्फ्यूरिक अम्ल NH3 से निम्न रासायनिक अभिक्रिया कर लेता है-
2NH3 + H2SO4 → (NH4)2 SO4
प्रश्न 9. SO2 विरंजक रूप् में किस प्रकार कार्य करती है? समझाइए
उत्तर – SO2 का विरंजक गुण उसके अपचायक गुण के कारण है परन्तु यह गुण पूर्णतया अस्थाई है। वायु में रखने पर पदार्थ अपनी पूर्व अवस्था में परिवर्तित हो जाता है।
SO2 + 2H2O → H2SO4 + 2[H]
रंगीन पदार्थ + 2[H] → रंगहीन (विरंजक चूर्ण)
प्रश्न 10. HF द्रव है जबकि अम्ल हाइड्रोजन हैलाइड गैसीय अवस्था पर पाए जाते है, कारण स्पष्ट कीजिए।
उत्तर – फ्लुओरीन (F) के छोटे आकार तथा उच्च विद्युत ऋणात्मकता के कारण HF अणु हाइड्रोजन आबन्ध द्वारा परस्पर बँधकर वृहद (विशाल) अणु का निर्माण कर लेते हैंं जिसके कारण अुणुभार बढ़ जाता है। अतः HF द्रव होता है । चूँकि HCl, HBr व HI हाइड्रोजन आबन्ध बनाने में सक्षम नहीं है, अतः यह गैसीय अवस्था में रहते हैं।
प्रश्न 11. उन दो विषैली गैसों के नाम लिखिए जो क्लोरीन गैस से बनायी जाती है?
उत्तर – फॉस्जीन (COCl2) तथा मस्टर्ड गैस (ClCH2CH2SCH2CH2Cl) विषैली गैसे हैं। इन्हें क्लोरीन गैस से बनाया जाता है।
प्रश्न 12. I2 से ICI अधिक क्रियाशील क्यों है?
उत्तर – I2 से ICI अधिक क्रियाशील होता है क्योंकि I – I आबन्ध से I – CI आबन्ध दुर्बल होता है परिणाम स्वरूप् ICI सरलता से टूटकर हैलोजन परमाणु देता है जो तीव्रता से अभिक्रिया करते हैं।
प्रश्न 13. क्लोरीन के निर्माण की डीकन विधि का रासायनिक समीकरण लिखिए।
उत्तर – डीकन विधि में HCl का ऑक्सीजन क्यूप्रस क्लोराइड की उपस्थिति में वायु की ऑक्सीजन द्वारा निम्नवत किया जाता है।
प्रश्न 14. रेडॉन की खोज किसने की? इसका उपयोग किस रोग के उपचार में किया जाता है?
उत्तर – सन् 1902 ई. में डॉर्न ने रेडियम (Ra) के रेडियों ऐक्टिव विघटन से रेडॉन की खोज की थी। इसका उपयोग कैंसर के उपचार तथा रेडियोऐक्टिवता के शोध कार्याें में किया जाता है।
प्रश्न 15. उत्कृष्ठ गैसों के आयतन विभव उच्च होते हैं क्यों?
उत्तर – उत्कृष्ठ गैसों के परमाणुओं के बाह्यतम कोश पूर्णतया संतृप्त तथा स्थायी होते हैं जिसके कारण बाह्यतम कोश से इलेक्ट्रॉन को पृथक् करने के लिए अधिक ऊर्जा व्यय करनी पड़ती है इनके आयतन विभव (इलेक्ट्रॉन को पृथक् करने में प्रयुक्त ऊर्जा) उच्च होते हैं।

प्रश्न 16. हीलियम का प्रमुख स्त्रोत क्या है?
उत्तर – रेडियोऐक्टिव खनिजों जैसे मोनोजाइट सेण्ड क्लीवाइट पिंच लेण्ड में यह अधिविष्ट रूप में उपस्थित होती है।
प्रश्न 17. हीलियम की गोताखोरी के उपकरणों में उपयोग क्यों किया जाता है?
उत्तर – आधुनिक गोताखोरी के उपकरणों में हीलियम ऑक्सीजन के तनुकारी के रूप में उपयोग में आती है क्योंकि रूधिर में इसकी विलेयता बहुत कम होती है।
प्रश्न 18. ओजोन की अम्लीय स्टैनस क्लाराइड एवं मर्करी के साथ अभिक्रिया का रासायनिक समीकरण दीजिए।
हल – (i) 3SnCl2 + 6HCl + O3 → 3SnCl2 + 3H2O
स्टैनस क्लोराइड स्टैनिक क्लोराइड
(II) 2Hg + O3 → Hg2O ↓ + O2↑
मरक्यूरस ऑक्साइड
कक्षा 12 सभी विषयों के महत्वपूर्ण प्रश्नों के नीचे दिए हुए लिंक पर क्लिक करें–
- mpbse 12th class PHYSICS imp question 2022 pdf download
- mpbse 12th class CHEMISTRY imp question 2022 pdf download
- mpbse 12th class BIOLOGY imp question 2022 pdf download
- mpbse 12th class MATH imp question 2022 pdf download
- mpbse 12th class HINDI imp question 2022 pdf download
- mpbse 12th class ENGLISH imp question 2022 pdf download
प्रश्न 19. SO2 के दो ऑक्सीकारक तथा दो अपचायक गुण लिखिए। केवल समीकरण दीजिए।
उत्तर – SO2 के दो ऑक्सीकारक गुण –
(I) 2H2S + SO2 → 2H2O + 3S↓
(II) 2SnCl2 + 4HCl + SO2 → 2SnCl2 + 2H2O + S↓
ऑक्सीकारक
SO2 के दो अपचायक गुण –
(I) Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
अपचायक
(II) 2FeCl3 + 2H2O + SO2 → 2FeCl2 + 2HCl + H2SO4
अपचायक
प्रश्न 20. हैलोजन रंगीन क्यों होते हैं?
उत्तर – हैलोजन के बाह्यतम कोश का इलेक्ट्रॉन प्रकाश अवशोषित करके उत्तेजित होकर उच्च ऊर्जा कोश में चला जाता है तथा मूल अवस्था में वापस आने पर ऊर्जा उत्सर्जित करता है जो अलग अलग तरंगदैर्ध्य की होती है। हैलोजन की उत्तेजित ऊर्जा हैलोजन परमाणु के आकार पर निर्भर करती है। आकार में कमी के साथ उत्तेजक ऊर्जा कम होती जाती है। यही कारण है कि फ्लुओरीन हल्के पीले रंग की होती है जबकि I2 बैंगनी।
लघु उत्तरीय प्रश्न (Class 12 Chemistry imp Question 2022 pdf)
प्रश्न 21. अक्रिय तत्वों की विशेषताएँ बताइए।
उत्तर – (i) यह रंगहीन गन्धहीन तथा स्वादहीन होते हैं।
(ii) यह सभी गैसें (Rn को छोड़कर) वायुमण्डल से अल्प मात्रा में पाई जाती है।
(iii) इनकी अंतिम कक्षा का विन्यास (हीलियम को छोड़कर) ns2p6होता है।
(iv) इनकी संयोजकता शून्य होती है।
(v) इनकी आयतन विभव अधिक होता है और He से Xe तक घटता है।
(vi) इनमें He से Xe तक परमाणु आकार वाष्पन की गुप्त ऊष्मा तथा घनत्व क्रमशः बढ़ता है।
प्रश्न 22. उत्कृष्ठ गैसें का आण्विक आकार हैलोजन से बड़ा होता है क्योें?
उत्तर – उत्कृष्ठ गैसों का आण्विक आकार हैलोजन के सापेक्ष अधिक होता है, क्योंकि इनके बाह्यतम कोश का विन्यास स्थायी होता है। जिसके कारण बाह्यतम कोश के इलेक्ट्रॉनों का नाभिक की ओर आकर्षण कम हो जाता है फलस्वरूप् आण्विक आकार अधिक होता है। उत्कृष्ठ गैसों में केवल वान्डरवाल्स त्रिज्या होती है तथा वाण्डरवाल्स त्रिज्या का मान सहसंयोजक त्रिज्या (जो हैलोजन में पाई जाती है) से सदैव अधिक होता है।
प्रश्न 23. अक्रिय गैसों के अक्रिय होने का कारण लिखिए।
अथवा उत्कृष्ठ गैसों के इलेक्ट्रॅानिक विन्यास संवृत्त कोश विन्यास कहलाते हैंउत्कृष्ठ स्पष्ट कीजिए।
अथवा उत्कृष्ट गैसों के अक्रिय होने का कारण लिखए तथा क्लीवाइट खनिज में पाये जाने वाले उत्कृष्ट गैस का नाम लिखिए।
उत्तर – उत्कृष्ठ या अक्रिय गैसें – उत्कृष्ठ या अक्रिय गैसों (He, Ne, Ar, Kr, Xe व Rn) की सभी कक्ष पूर्णतया भरे होने के कारण ये संतृप्त या संवृत्त होती है और उसी कारण रासायनिक रूप् में निष्क्रिय होती है।
2He = 1s2
10Ne = 1s2, 2s2, 2p6,
18Ar = 1s2, 2s2, 2p6, 3s2, 3p6
36 Kr = 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6
इनकी बाह्यतम कक्ष में 8-8 इलेक्ट्रॉन होते हैं, अतः यह इलेक्ट्रॉन का आदान-प्रदान नहीं करती है जिसके कारण इनकी संयोजकता शून्य होती है। इस कारण इसको शून्य वर्ग या वर्ग 18 में रखा गया है। क्लीवाइट गुब्बारों को भरने तथा समुद्री गोताखोरों द्वारा कृत्रिम श्वसन में किया जाता है।
प्रश्न 24. अम्लराज क्या है? यह प्लेटिनम से किस प्रकार क्रिया करती है? इसकी गोल्ड से अभिक्रिया दीजिएं
उत्तर – अम्लराज (ऐक्वारेजिया) – 3 भाग सान्द्र HCl तथा 1 भाग HNO3 को परस्पर मिलाने से बने मिश्रण को अम्लराज कहते हैं।
अम्लराज एक प्रबल ऑक्सीकारक है और लगभग सभी धातुओं से क्रिया करता है। यह सभी उत्कृष्ट धातुओं (Au, Pt आदि ) को घोल लेता है। अम्लराज नवजात क्लोरीन तथा नाइट्रोसिल क्लोराइड मुक्त है जिसके कारण यह बहुत अभिक्रियाशील होता है।
अभिक्रिया
(I) प्लेटिनम के साथ अभिक्रिया –
Pt + 2HNO3 + 6HCl → PtCl4 + 2NOCl
प्लैटिनेक क्लोराइड नाइट्रासिल क्लोराइड
PtCl4 + 2HCl → H2PtCl6
क्लोरोप्लैटिनेक अम्ल
(II)गोल्ड के साथ अभिक्रिया –
2Au + 3HNO3 + 9HCl → 2AuCl3 + 3NOCl + 6H2O
ऑरिक क्लोराइड नाइट्रासिल क्लोराइड
AuCl3 + HCl → HAuCl4
प्रश्न 25. निम्नलिखित गैसों के मुख्य उपयोग लिखिए।
(I) हीलियम
(II) आर्गन
उत्तर – हीलियम के उपयोग –
1. गुब्बारों, वायुयानों के टायरों आदि में भरने के काम आती है।
2. निर्वात नलियों, रेडियों नलियों आदि के भरने के काम आती है।
3. बहुत कम ताप उत्पन्न करने के काम आती है।
4. इसका ऑक्सीजन के साथ मिश्रण गोताखोरों द्वारा सांस लेने के कारण काम आता है।
आर्गन के उपयोग –
1. निऑन के साथ इसका मिश्रण चमकने वाले विज्ञानिकों के काम आता है।
2. यह धातु तनु का जीवन बढ़ा देती है अतः यह विद्युत लैम्पों, रेडियो, बल्बों आदि में भरने के काम आती है।
3. आर्गन आर्क का उपयोग ऐल्युमिनियम तथा स्टेनलेस स्टील के जोड़ने में किया जाता है।
दीर्घ उत्तरीय प्रश्न ( Class 12 Chemistry imp Question 2022 )
प्रश्न 26. अमोनिया का औद्योगिक उत्पादन हैबर विधि द्वारा कैसे किया जाता है? उन कारकों को लिखिए जिनकी वजह से अमोनिया का उत्पादन अधिक हो जाता है। अमोनिया के औद्योगिक उत्पादन का नामांकित चित्र भी दीजिए।
अथवा
हैबर विधि द्वारा अमोनिया के औद्योगिक निर्माण विधि का सचित्र वर्णन कीजिए। इसकी निम्न के साथ अभिक्रिया का समीकरण लिखिए।
(i) AgCl (II) Cl2 (III) CuO
अथवा
अमोनिया के हैबर प्रक्रम द्वारा उत्पादन का वर्णन प्रवाह चित्र एवं रासायनिक समीकरण द्वारा कीजिए।
अथवा
अमोनिया के दो महत्वपूर्ण उपयोग लिखिए।
अथवा
हैबर विधि द्वारा अमोनिया का निर्माण कैसे किया जाता है? नामांकित चित्र सहित वर्णन कीजिए इसकी Cl2 के सााि क्रिया भी लिखिए।
उत्तर – हैबर विधि का सिद्धांत – यदि शुद्ध नाइट्रोजन और हाइड्रोजन के 1ः3 अनुपात के मिश्रण को गर्म किया जाए तो अमोनिया बनती है।
N2 + 3 H2 ⇔ 2 NH3↑ + 23.400 कैलोरी
यह एक ऊष्माक्षेपी उत्क्रमणीय अभिक्रिया है और क्रिया के पश्चात आयतन में कमी होती है, इसलिए ला शातेलिए के नियमानुसार कम ताप और अधिक दाब पर अमोनिया अधिक उत्पन्न होगी। कम ताप पर अभिक्रिया का वेग बढ़ाने के लिए एक उत्प्रेरक प्रयोग किया जाता है। इस अभिक्रिया का उत्प्रेरक की उपस्थिति में अनुकूलतम कम ताप 450 – 5000ºC तथा उच्च दाब 200 वायुमण्डल है क्योंकि अभिक्रिया उत्क्रमणीय है, इसलिए अमोनिया को लगातार क्रिया क्षेत्र से हटाने पर अमोनिया गैस अधिक बनेगी। इस अभिक्रिया में लोहे का बारीक चूर्ण तथा मॉलिब्डेनम की सूक्ष्म मात्रा प्रयुक्त होती है। इसमें गैसीय मिश्रण शुद्ध होना चाहिए जिससे उत्प्रेरक विभक्त न हो।
विधि – शुद्ध N2 तथा H2 को 1ः3 के अनुपात में मिलाकर 200 वायुमण्डल दाब पर तप्त लोहे के बारीक चूर्ण को जिसमें मॉलिब्डेन मिला होता है। ताप पर गर्म करते हैं। इस विधि में अमोनिया बनती है जिसे संद्यनित्र में प्रवाहित करके द्रवित कर लेते हैं। शेष गैसों को फिर से उत्प्रेरक कक्ष में प्रवाहित करते हैं जिससे N2 व H2 के संयोजन द्वारा NH3 का लगातार उत्पादन होता रहता है।
गुण –
- क्लोरीन से अभिक्रिया –
A) अमोनिया के आधिक्य में क्लोरीन के साथ नाइट्रोजन तथा अमोनियम क्लोराइड बनते हैं।
2NH3 + 3Cl2 → 6HCl + N2↑
6HCl + 6NH3 → 6NH4Cl
8NH3 + 3Cl2 → 6NH4Cl + N2↑
B) क्लोरीन की अभिक्रिया में अमोनिया की क्रिया से नाइटोजन ट्रायक्लोराइड और HCl बनते हैं।
3Cl2 + NH3 → NCl3 + 3HCl
नाइटोजन ट्रायक्लोराइड एक विस्फोटक पदार्थ है।
2. लाल तप्त CuO से क्रिया –
यह लाल तप्त काॅपर आक्साइड को काॅपर में अपचयन कर देती है।
रक्त तप्त
3CuO + 2NH4 → 3Cu↓ + 3H2O + N2↑
3. सिल्वर क्लोराइड से अभिक्रिया- संकर लवण बनाता है।
AgCl + 2NH3 → [Ag(NH3)2]Cl
सिल्वर डाइऐमीनो क्लोराइड (डाइऐमीनो सिल्वर क्लोराइड)
उपयोग – 1. कृत्रिम रेशम बनाने में
2. बर्फ बनाने तथा
3. कोल्ड स्टोरेज में प्रशीतक के रूप् में क्योंकि इसके वाष्पन की गुप्त ऊष्मा 327 कैलोरी ग्राम-1 (उच्च) होती है।
कक्षा 12 सभी विषयों के नोट्स पाने के लिए नीचे दिए हुए लिंक्स् पर क्लिक करें–
- mpbse 12th class physics notes 2022 pdf download
- mpbse 12th class chemistry notes 2022 pdf download
- mpbse 12th class math notes 2022 pdf download
- mpbse 12th class biology notes 2022 pdf download
- mpbse 12th class hindi notes 2022 pdf download
- mpbse 12th class english notes 2022 pdf download
प्रश्न 27. सल्फर की अपररूपता पर संक्षिप्त टिप्पणी लिखिए।
अथवा
सल्फर के अपररूपता पर टिप्पणी लिखिए।
उत्तर – सल्फर के अपररूप् – सल्फर के अनेक अपररूप् हैं। इनमें पीली विषमलंबाक्ष (a – सल्फर) तथा एकनताक्ष (b -सल्फर) रूप् अति महत्वपूर्ण है। कमरे के ताप पर विषमलंबाक्ष सल्फर को 369k ताप पर गर्म करने पर यह एकनताक्ष सल्फर मेें रूपांतरित हो जाती है।
A) विषमलंबाक्ष सल्फर सल्फर –
1. यह अपररूप पीले रंग का होता है।
2. इसका घनत्व 2.06 है तथा यह में विलेय है।
3. यह क्रिस्टलीय रूप है। यह 58 के रूप् में क्रिस्टल में व्यवस्थित होता है।
इनकी संरचना निम्न प्रकार की होती है –
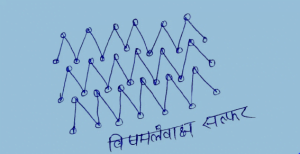
इनमें वलय एक – दूसरे से आराम से फिट होती चली जाती है। यह जल में अविलेय है।
इसका गलनांक 385K है।
इन्हें गंधक श्लाका के Cs2 विलयन को वाष्पीकृत करके बनाया जाता है।
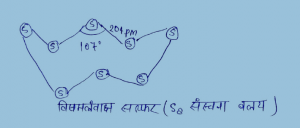
एकनताक्ष (monoclinic) सल्फर (b – सल्फर) –
1. इसका गलनांक 393k है। 58 की आक्सीकरण संख्या शून्य होती है।
2. इसका घनत्व 1.98 है। तथा यह Cs2 में विलेय है।
3. इसका अपररूप् को बनाने के लिए विषमलम्बाक्ष गंधक को एक तस्तरी में पिद्यलाकर तथा पपड़ी बनने तक ठण्डा करते हैं इस पपड़ी में दो छिद्र करते हैं। जिनमें से बचा हुआ द्रव निकाल लिया जाता है। पपड़ी को हटाने पर रंगहीन सुई के आकार के b – सल्फर के क्रिस्टल बनते हैं।
4. यह 369k के ऊपर ताप पर स्थायी होते हैं।
5. 369k ताप के नीचे ताप पर a – सल्फर में रूपांतरित हो जाते हैं। इसके विपरीत a – सल्फर 369k से नीचे ताप पर b – सल्फर में रूपांतरित हो जाता है।
6. 369k ताप पर दोनों रूप स्थायी है। इस ताप को संक्रमण ताप पर कहते हैं।
प्रश्न 28. शीश कक्ष विधि द्वारा सल्फ्यूरिक अम्ल के निर्माण का सचित्र वर्णन कीजिए। संयत्र के प्रत्येक भाग में होने वाली रासायनिक अभिक्रियाओं के रासायनिक समीकरण भी दीजिए।
अथवा
सीस कक्ष विधि द्वारा सल्फ्यूरिक अम्ल के औद्योगिक निर्माण का नामांकित चित्र सहित वर्णन कीजिए। अभिक्रियाओं के समीकरण दीजिए।
अथवा
सीस कक्ष प्रक्रम द्वारा सल्फ्यूरिक अम्ल के निर्माण की विधि का सचित्र वर्णन कीजिए। इसके दो निर्जली कारक गुण भी लिखिए।
सम्बंधित सभी अभिक्रियाओं के समीकरण लिखिए।
सल्फ्यूरिक अम्ल के निर्माण की सीस कक्ष विधि का रासायनिक समीकरण देते हुए सचित्र वर्णन कीजिए।
H2SO4 की PCl5 तथा KI से अभिक्रिया का रासायनिक समीकरण लिखिए।
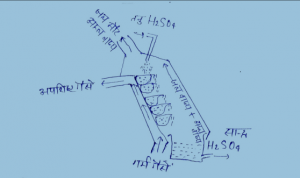
उत्तर – सीस कक्ष विधि द्वारा सल्फ्यूरिक अम्ल का निर्माण –
इस प्रक्रम में प्रयुक्त संयत्र के विभिन्न भागों में होने वाली अभिक्रियाएं अग्रलिखित है –
1. पाइराइट बर्नर – इन भट्टियों में गंधक या आरन पाइराइट को वायु में जलाकर SO2 प्राप्त की जाती है।
S + O2 → SO2 ↑
4FeSe + 11O2 → 2FeO3 + 8SO2 ↑
आयरन पाइराइट
2. नाइटर पात्र – इन पात्रों में NaNO3 तथा सान्द्र H2SO4 का मिश्रण भरा होता है। जब इनके ऊपर से SO2 तथा वायु का मिश्रण प्रवाहित होता है तो HNO3 वाष्प् तथा नाइट्रोजन के आक्साइड बनते हैं।
NaNO3 + H2SO4 → NaHSO4 + HNO3विषमलंबाक्ष
4HNO3 → 4NO2↑ + O2 ↑ + 2H2O
आधुनिक संयत्रों में अमोनिया का वायु से Pt की उपस्थिति में आक्सीकरण किया जाता है। इन अभिक्रियाओं में नाइट्रोजन के आक्साइड बनते हैं।
4NH3 + 5O2 → 4NO ↑ + 6H2O ( pt की उपस्थिति में )
2NO + O2 → 2NO2↑
3. धूल कक्ष – यहां पर नाइट्रोजन के आक्साइड वायु और SO2 के मिश्रण में उपस्थित धूल के कण भाप के सम्पर्क में आकर भारी होकर नीचे बह जाते हैं।
4. ग्लोबर स्तम्भ – यह अम्लरोधक ईंटों का बना स्तम्भ होता है जिसमें फ्लिण्ड पत्थर के टुकड़े पाए जाते हैं। इसके ऊपर दो टंकिया होती हैं एक टंकी से नाइट्रोसो सल्फ्यूरिक अम्ल तथा दूसरी से तनु कक्ष अम्ल टपकता रहता है। नीचे से SO2 वायु तथा नाइट्रोजन के आक्साइडों का मिश्रण धीरे-धीरे ऊपर चढ़ता है। इस टावर में अग्रलिखित क्रियाएं होती हैं-
1. गैसीय मिश्रण का ताप 50.800C तक गिर जाता है।
2. SO2 की कुछ मात्रा NO2 व भाप से क्रिया करके H2SO4 में परिवर्तित हो जाती है।
SO2 + NO2 + H2O → H2SO4 + NO↑
3. सीस कक्ष से आने वाला तनु अम्ल गर्म गैसों के सम्पर्क में कक्ष आकर सान्द्र हो जाता है।
4. गेलूसिक स्तम्भ से आने वाला नाइट्रेटिड H2SO4 नाइट्रोजन के आक्साइडों से मुक्त हो जाता है और सान्द्र H2SO4 प्राप्त होता है।
2[NO.HSO4] + H2O → 2H2SO4 + NO ↑ + NO2↑
नाट्रोसो सल्फ्यूरिक अम्ल
5. लेड सीस कक्ष – यह कक्ष लेड के बने होते है। ग्लोवर टावर से गैसीय मिश्रण इन कक्षों में लाया जाता है। और ऊपर से जलवाष्प् छोड़ी जाती है, जो गैसीय मिश्रण के साथ H2SO4 बनाती है।
2SO2 + O2 + 2NO + 2H2O → 2H2SO4 + 2NO↑
यह अम्ल कक्षों के फर्श पर एकत्रित हो जाता है इस अम्ल को कक्ष अम्ल (60-70% H2SO4) कहते हैं।
6. गैलुसैक स्तम्भ – सीस कक्ष से निकलने वाली गैसों में नाट्रोजन के आक्साइड होते हैं। इन गैसों को गैलुसेक स्तम्भ में नीचे से ऊपर की ओर चढ़ाया जाता है। इस स्तम्भ में कोक भरा रहता है। इसमें ऊपर की टंकी से ठण्डा H2SO4 बूँद-बूँद करके टपकाया जाता है जो कि गैसीय मिश्रण में उपस्थित नाइट्रोजन के आक्साइडों को अवशोषित कर लेता है और नाइट्रोसो सल्फ्यूरिक अम्ल बनाता है जिससे ग्लोबर स्तम्भ में भेजा जाता है।
2H2SO4 + NO + NO2 → 2[H2SO4.NO] + N2O
नाइट्रोसो सल्फ्यूरिक अम्ल
7. अम्ल का सान्द्रण
चैम्बर अम्ल में भार के विचार से 60 – 70% H2SO4 होता है। इसका सान्द्रण कासकैड विधि द्वारा किया जाता है।
8. कासकैड विधि – इस विधि में चैम्बर अम्ल को सिलिका के प्यालों में गर्म किया जाता है।ये सिलिका के प्याले सीढ़ियों पर इस प्रकार रखे जाते हैं कि ऊपर का प्याला भर जाने पर अम्ल उससे नीचे के प्याले में आ जाता है। एक भट्टी से प्राप्त गर्म गैसों को सीढ़ियों के नीचे से प्रवाहित करते हैं अम्ल ऊपर से नीचे धीरे – धीरे गिरता जाता है और इसमें उपस्थित जल वाष्पित होता है। इस प्रकार अम्ल सान्द्र हो जाता है और इसको सबसे नीचे रखे पात्र में एकत्रित कर लेते हैं। इस प्रकार 90% सल्फ्यूरिक अम्ल प्राप्त हो जाता है।
9. KI से अभिक्रिया – सान्द्र H2SO4 . KI को I2 में आक्सीकृत बर देता है।
2KI + 2H2SO4 → K2SO4 + 2H2O + I2↑
10. कार्बन से अभिक्रिया – सान्द्र H2SO4 कार्बन को CO2 में आक्सीकृत कर देता है।
C + 2H2SO4 → CO2 ↑ + SO2 ↑ + 2H2O
11. H2S से अभिक्रिया – सान्द्र H2SO4 . H2S को सल्फर में आक्सीकृत कर देता है।
गर्म
H2SO4 + H2S → 2H2O + SO2↑ S↓
12. I2 से अभिक्रिया – सान्द्र H2SO4 . I2 को आयोडिकअम्ल (HIO3) में आक्सीकृत कर देता है।
I2 + 5H2SO4 → 2HIO3 + 4H2O + 5SO2↑
आयोडिक अम्ल
[WPSM_AC id=969]
कक्षा 12 रसायन विज्ञान के सम्पूर्ण पाठों के महत्वपूर्ण प्रश्न 2022 बोर्ड परीक्षा के लिए ( 12th Chemistry Important Questions in hindi 2022 )
| पाठ संख्या | पाठ का नाम | डाउनलोड लिंक |
| 01. | ठोस अवस्था | Click Here |
| 02. | विलियन | Click Here |
| 03. | विधयुत रसायन | Click Here |
| 04. | रासायनिक बलगतिकी | Click Here |
| 05. | प्रष्ट रसायन | Click Here |
| 06. | तत्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम | Click Here |
| 07. | p- ब्लाक के तत्व | Click Here |
| 08. | d और f – ब्लाक के तत्व | Click Here |
| 09. | उपसहसंयोजन यौगिक | Click Here |
| 10. | हैलोएल्केन्स और हैलोएरीन्स | Click Here |
| 11. | ऐल्कोहाल, फिनाल और ईथर | Click Here |
| 12. | एल्डिहाइड, कीटोन, कार्बोक्सिलिक अम्ल | Click Here |
| 13. | नाइट्रोजन युक्त कार्बनिक यौगिक | Click Here |
| 14. | जैव अणु | Click Here |
| 15. | बहुलक | Click Here |
| 16. | रोजमर्रा की जिंदगी में रसायन शास्त्र | Click Here Here |
Class 12 Chemistry imp Question 2022 आज के इस पोस्ट में आप पढ़ रहे है। जो कि आपके बोर्ड परीक्षा 2022 के लिए बहुत महत्वपूर्ण साबित होंगे। ओर अगर आपको ये पोस्ट अच्छा लगा हो तो इस पोस्ट को ज्यादा से ज्यादा शेयर जरूर करें।
| JOIN TELEGRAM GROUP | CLICK HERE |
| PHYSICSHINDI HOME | CLICK HERE |

Tauseef was born in Deharadoon, Uttarakhand. He began writing in 2021, and has contributed to the educational and finance content. He lives in Nainitaal.
Leave a Reply